目前研究大脑发育和疾病使用最广泛的小鼠模型与人脑之间存在着大小、结构、细胞间相互作用等诸多方面的差异。而人脑类器官源自人体自组织,可以忠实地模拟人脑的结构与功能。自2013年Madeline A Lancaster等首次开发至今[1],其已成为可系统性概述大脑皮层不同区域,包括海马体、中脑、丘脑、下丘脑、小脑等的发育特征的重点模型。
在相关研究如火如荼的当下,2024年12月12日,美国南加州大学洛杉矶分校和英国剑桥大学的研究团队联合在Nature子刊Nature reviews. Molecular cell biology发表了题为“Modelling human brain development and disease with organoids”的重磅综述,对脑类器官的研究现状和应用场景进行了系统性阐释。作者首先回顾了多种优化人脑类器官生理相关性的方式,同时汇总了脑类器官应用场景及研究进展。最后,作者还对脑类器官面临的社会伦理问题进行了提醒,并点明了眼下研究的困局,指明了未来的重点发展方向。

(来源:参考资料[2])
01 脑类器官的建立与优化
胎儿脑干细胞、皮质组织干细胞和组织干细胞(hPSCs)来源的脑类器官培养方法均已建立。从各种方式获得的干细胞在体外首先形成3D的拟胚体(EB),而后进行2-5天的神经诱导,从外胚层形成神经板,神经板闭合形成神经管。接下来,神经管内壁的神经上皮干细胞向不同的神经细胞命运分化。与此同时,神经管发育为前脑、中脑以及后脑三个初级脑泡。前脑进一步发育为端脑和间脑,其中端脑发育为大脑皮层,而间脑发育为丘脑、下丘脑、视网膜等其他区域。
已有大量研究鉴别了大脑发育过程中多个关键信号通路。相应地,需要在脑类器官培养的不同阶段合理地添加或抑制相关生长因子进行调控。碱性成纤维细胞生长因子(bFGF)在最初干细胞分化为拟胚体的过程中添加,以刺激神经发生和胶质细胞生成。此外,在类器官生成的早期阶段抑制WNT信号有助于抑制中胚层谱系,并加强向强皮质身份的分化。
由于缺乏真正的信号生发中心,现如今的脑类器官培养中,不同细胞的分化命运依赖于形态发生素的浓度梯度。SHH作为一种形态发生素,其信号强度可决定神经管腹侧细胞的分化命运。高浓度的SHH诱导腹部神经元的形成,而低浓度的SHH则诱导运动神经元等的形成。骨形态发生蛋白(BMP)也是形态发生素的一种,其参与调控神经诱导到分化的整个阶段,可促进背部神经细胞的命运,调节神经嵴的形成,并影响胶质细胞的生成和神经元亚型的特化。脑源性生长因子(BDNF)、神经营养因子-3(NT-3)、胶质细胞源性神经营养因子(GDNF)等也参与神经元的分化和成熟,尤其是多巴胺能和GABA能突出的正常生长。
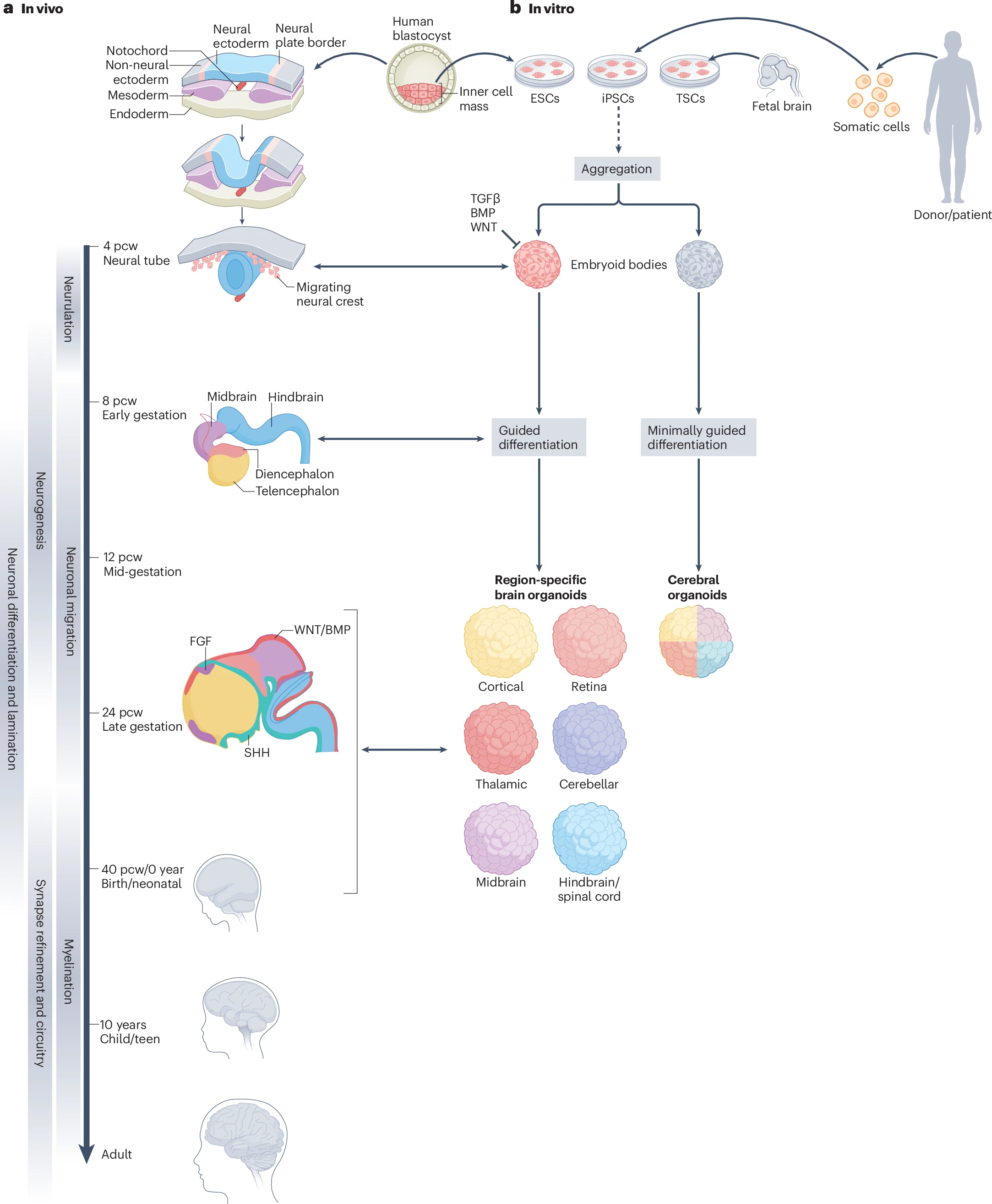
图1:模拟脑发育,建立脑类器官
(来源:参考资料[2])
本综述中,作者着重提出,为了创建复杂神经发育过程的精确模型,还需要对细胞多样性、结构复杂性和成熟过程进行多重优化,以提高人脑类器官的生理相关性。
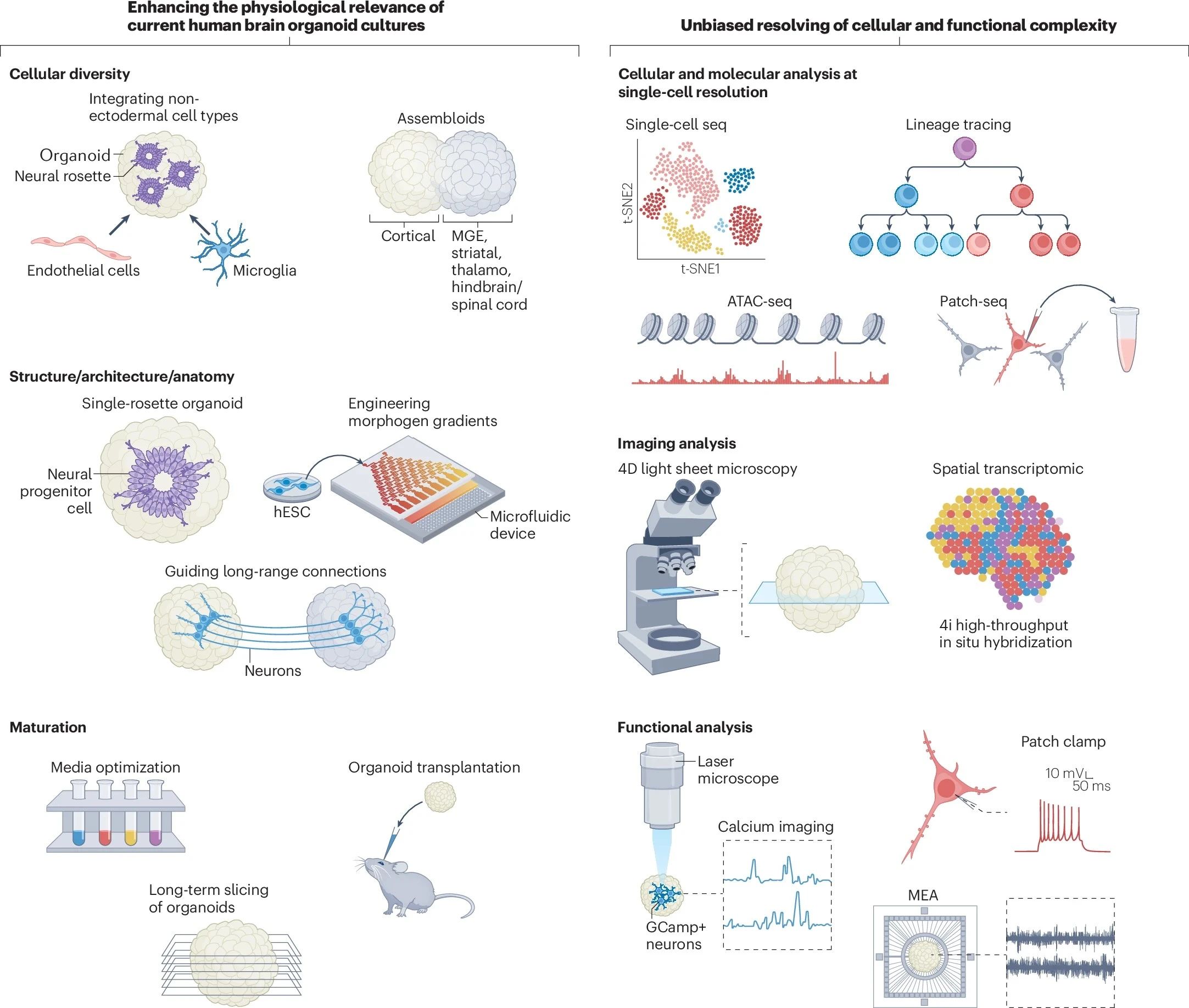
图2:脑类器官的优化路线
(来源:参考资料[2])
增加细胞多样性
除神经元外,胶质细胞如星形胶质细胞和少突胶质细胞等在大脑发育中起到结构支持、营养等重要作用。澳大利亚和韩国科学家们已经通过添加肝细胞生长因子(HGF)、胰岛素生长因子(IGF)等,成功将培养出成熟少突胶质细胞的时间从原本的100天以上缩减到约40天(图3)[3]。

图3:短期诱导成熟少突胶质细胞生成的方法
(来源:参考资料[3])
此外,非外胚层细胞,如来自于中胚层的小胶质细胞也对捕获脑发育和病理学复杂性至关重要,而神经血管网络也是准确模拟大脑后期发育所不可或缺的。研究表明,用血管内皮生长因子(VEFG)和生长因子WNT7B共处理脑类器官,并将内皮细胞与脑类器官共培养可诱导血管化。事实上,已有研究团队通过将大脑类器官与血管类器官融合,首次构建出具有人类血脑屏障全功能的脑类器官,为神经系统疾病机理研究及药物提供了更为可靠的平台(图4)[4]。
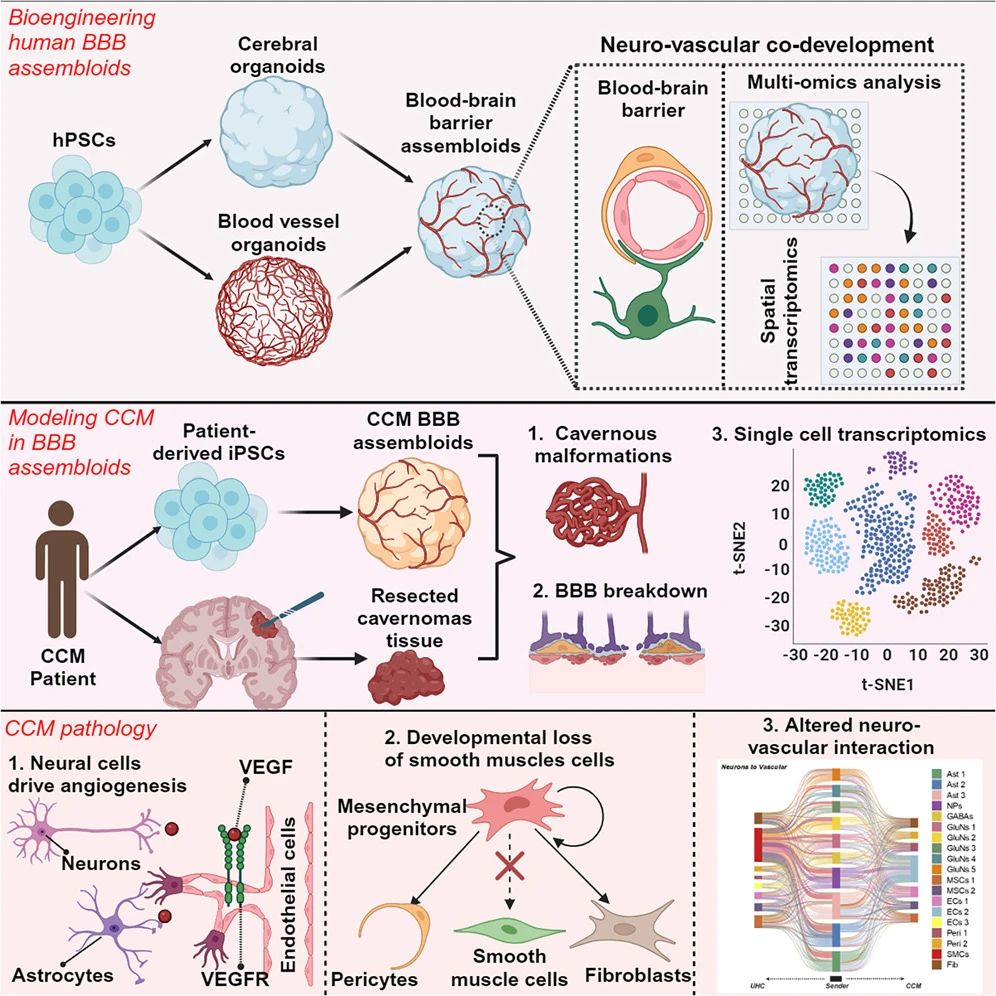
图4:生成具有人类血脑屏障全功能脑类器官的路径
(来源:参考资料[4])
另外,共培养向不同脑命运分化的单个类器官,也可模拟神经系统和不同区域神经元之间功能链接的形成。定义涵盖有皮质、内侧神经节隆起(MGE)、丘脑、后脑/脊髓等多个区域特异性类器官的融合体为类组装体(assembloids)。此举可增强多样性以研究细胞迁移、整合和突触形成。
提升结构相似性
为了获得更接近生理大脑的结构,首先需要工程化的水凝胶、微纤维支架等多种结构支撑技术。
另外,如前文所述,形态发生素浓度梯度对于神经元祖细胞位置和身份的发也至关重要。为此,可以使用合成生物学方法,工程化诱导形态发生素SHH的释放,激活背腹和前后位置轴上有序的自组织以形成模式化的前脑亚区。区别于前文所述“单个类器官共培养”方案,这相当于从另一条“一镜到底”的通路,由形态发生素浓度梯度直接诱导了不同的脑区分化,并最终形成整合了不同区域特异性的“类组装体”。其后FGF-8的添加可进一步协助产生轴向模式化的皮层类器官以探索更复杂的表型。
另一方面,微流控装置也可辅助精准控制形态发生素的递送。已经通过微流控验证发现,视磺酸和SMO激动剂的正交梯度可模拟形态发生素对运动神经元分化的组合作用。使用微流控,还可在hPSC分化期间产生WNT梯度以模拟神经管的发育(图5)[5],该方法也被称为“微流控控制的干细胞区域化”(MiSTR)。总之,微流控具有外部调控形态发生素的时空梯度以控制PSC自组织模块化的能力。
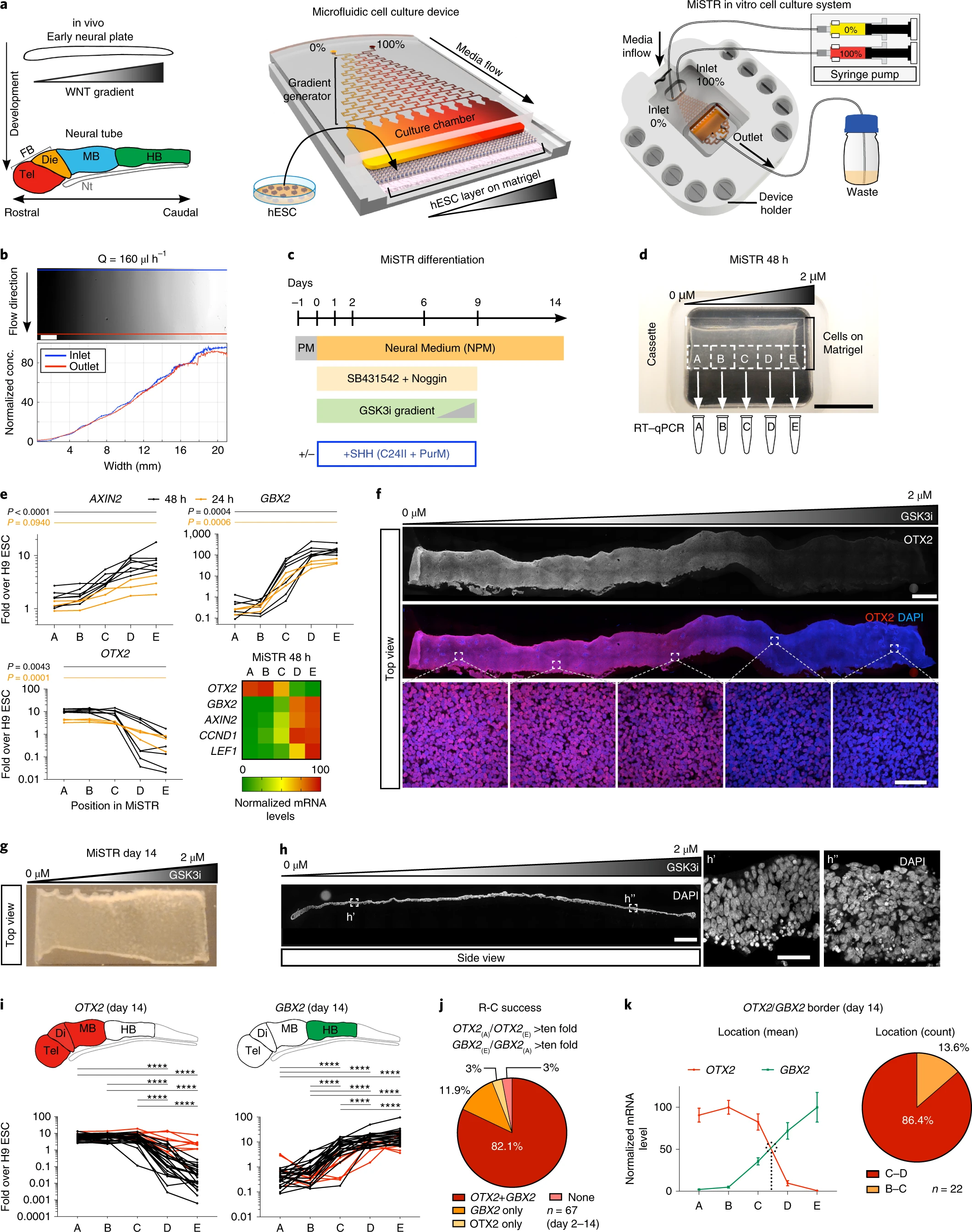
图5:MiSTR细胞培养系统的设计和hESC衍生组织中WNT信号传导梯度的建立
(来源:参考资料[5])
促进成熟与功能化
其后,作者回顾了促进类器官成熟和功能性的手段,再次肯定了微流控系统对于控制不同脑区之间远程信息沟通、模拟体内脑回路方面的重要意义。此外,切片培养和气-液界面培养也可改善脑类器官的氧供应并减少细胞死亡(图6)[6]。
小分子混合物如GENtoniK等可促进脑类器官成熟,也可考虑引入模型的构建。异种移植也是增强hPSC衍生的神经元的结构和功能特征的重要策略。对移植类器官的分析已经揭示了进行性神经元分化和成熟、胶质生成、宿主小胶质细胞的整合、脉管系统的侵袭以及与宿主大脑形成功能连接的轴突的建立。
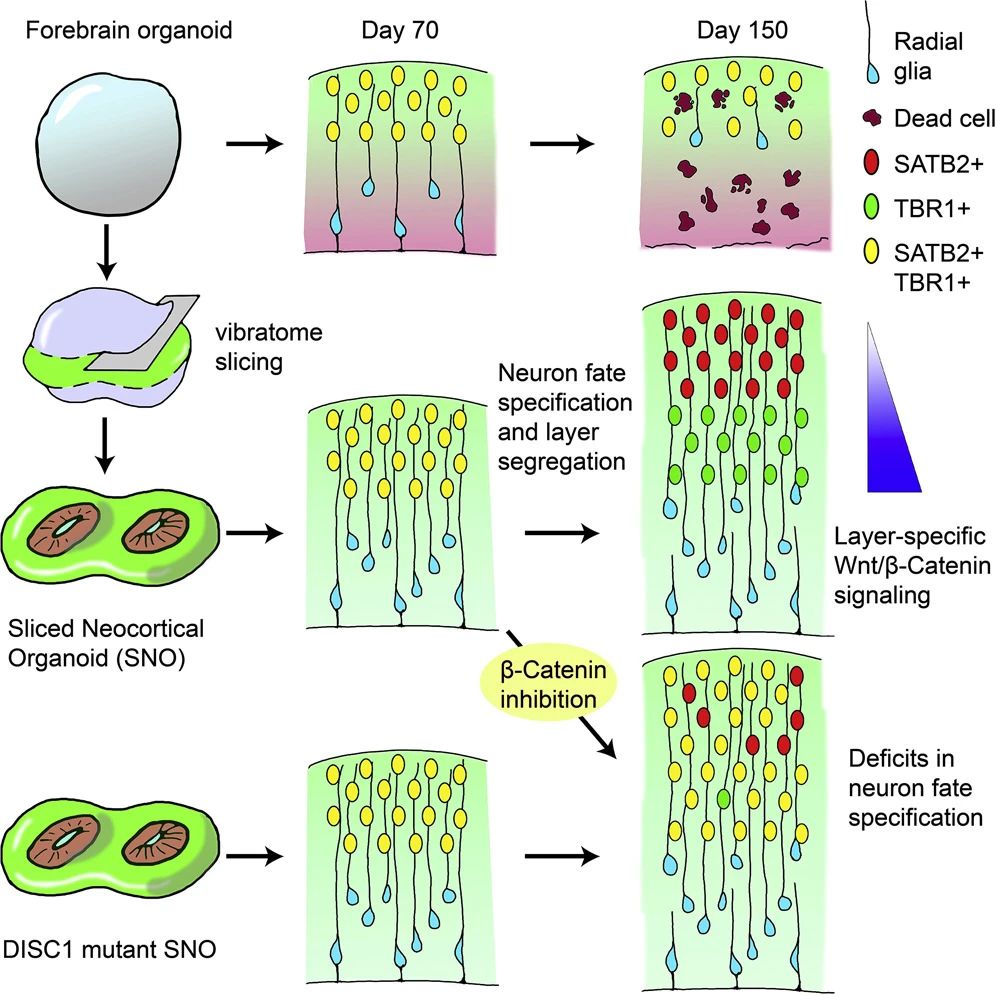
图6:新皮质类器官切片克服内部缺氧难题并减少细胞死亡
(来源:参考资料[6])
02 脑类器官的应用
脑类器官的主要应用在于模拟多种脑部疾病以提供机理探索、毒性测试和药物筛选的体外平台。在此,作者首先概括了多种使用脑类器官模型获得重大突破的病症实例。
譬如,无脑回畸形综合征(MDS)属于严重的皮质畸形。来自MDS患者的脑类器官研究提示,N-钙粘蛋白-β-catenin/WNT信号通路的破坏可能是主要病因之一。而在神经发育障碍中,患者来源的皮质类器官已用于辅助具有强烈临床异质性的特发性孤独症谱系障碍(ASD)的病因探索,并挖掘出了包括FOXG1在内多个差异性表达的发病关键基因。在神经精神疾病方面,也有报道利用来自双相情感障碍患者的脑类器官揭示了疾病相关的各种分子、细胞和功能表型特征。在传染病领域,脑类器官也已用于SARS-CoV-2、HIV等病毒感染模式的研究,并为确定放射状胶质祖细胞的耗竭为寨卡病毒感染引起的获得性小头畸形主要病因做出了贡献。
![]()
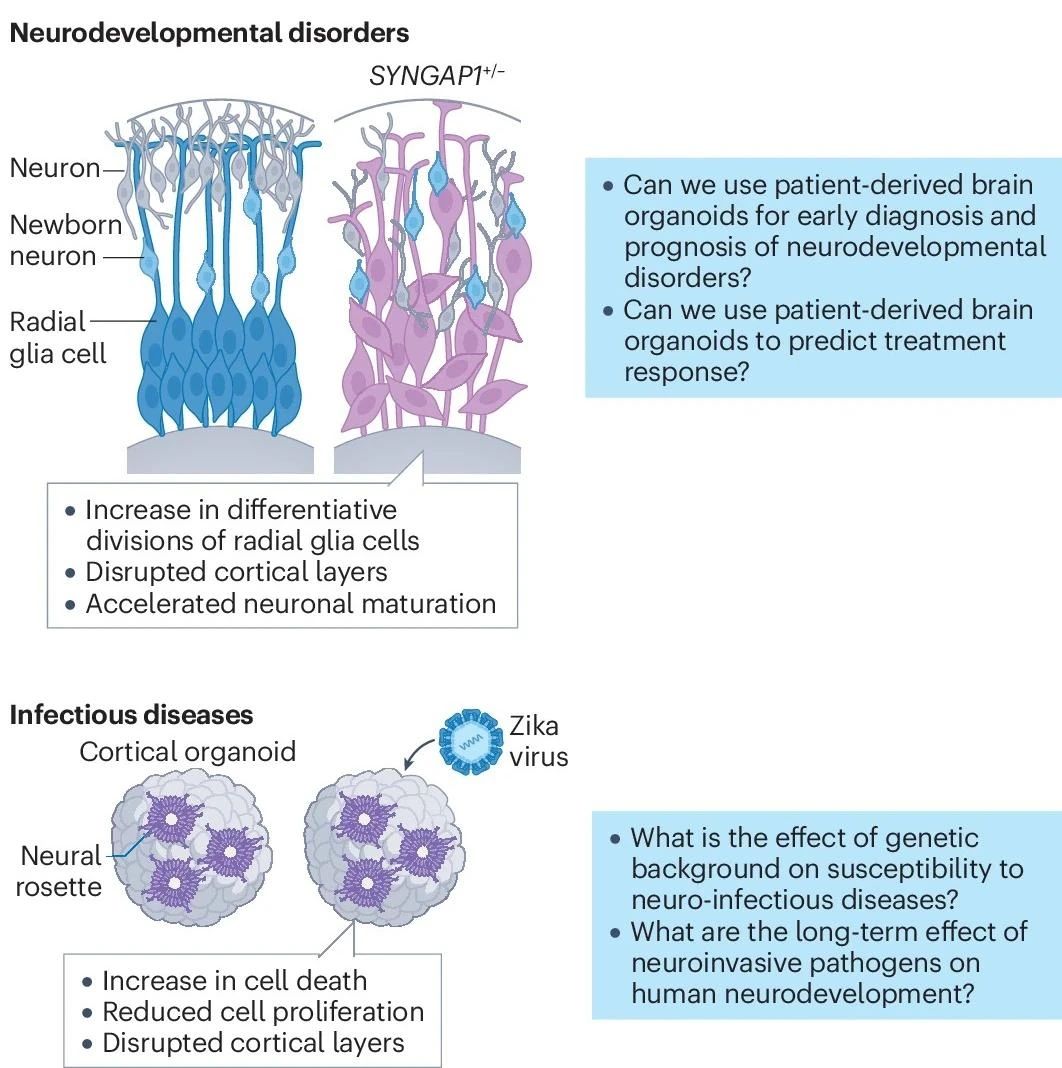
图7:脑类器官用以疾病探索
(来源:参考资料[2])
除疾病诊疗外,脑类器官还可参与进化多样性的探讨。通过对比非人灵长类和人脑类器官,已经进行了从大脑层面到信号通路与基因层面不同尺度上的差异化研究,并协助人类大脑发育独特特征的解析。
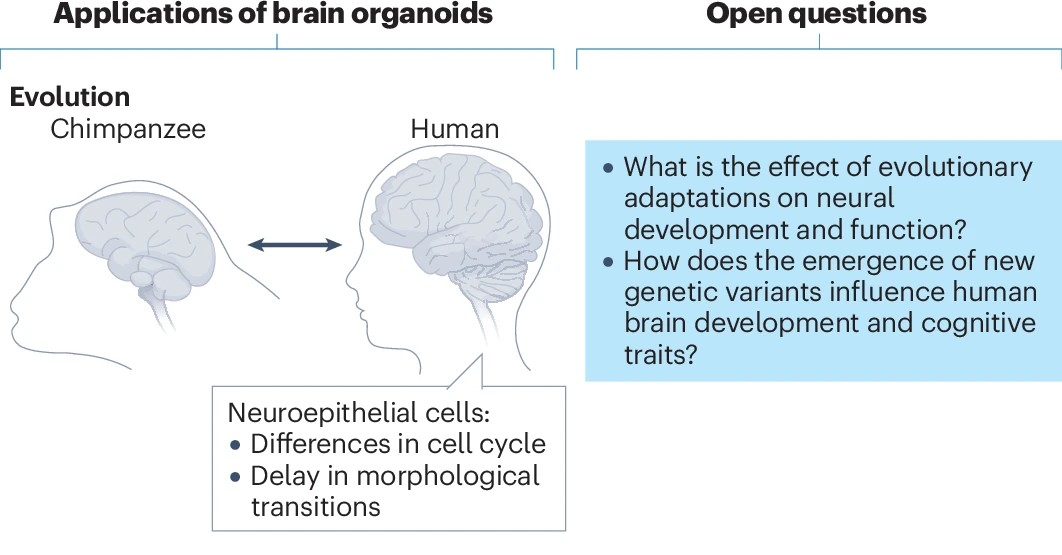
图8:脑类器官探究大脑进化
(来源:参考资料[2])
03 社会伦理
尽管目前脑类器官的开发已经取得了巨大成功,然而作者提醒,在道德伦理层面还需保持更为审慎的态度。
首先,干细胞的获取必须获得捐赠者的书面同意。中国科学院动物研究所彭耀进等的论文也提到,需要确保捐赠者完整明确地知晓生物样本地使用方式与方法,且理解正确全面,并拥有全部的自主决定权[7]。
针对脑类器官,尤其需要严谨定义脑类器官中的意识状态。仅就目前而言,脑类器官尚未企及人脑复杂程度,并不具备真正的意志认知,因此在科学传播的过程中应当格外注意遣词造句,避免以“小型化的人类大脑”等词误导业界和公众。且随着脑类器官的研究发展,需要从伦理和法律的角度全面地审视其未来可能呈现的人类特征。
此外,脑类器官的来源样本库当下严重缺乏多样性。作者提到,hPSC库主要由具有欧洲血统的供体组成。且由于长时间培养下X染色体容易失活的影响,干细胞的选取也偏向于男性来源的样本。作者强调,确保脑类器官来源的人种、地域、语言、文化、性别等多样性,对人类健康的全面理解和探索疾病的异质性至关重要。未来仍需加强在此方面的努力,确保通过脑类器官模型获取的疗法可公平平等地惠及所有人群。
04 总结与展望
本文提供了脑类器官从技术到应用全生态全景路线图,为渴望了解深入脑类器官领域的研究者提供了重要指南。
展望未来,作者强调,对于脑类器官技术上的改进,或集中在通过应用各种生物工程方法促进神经元的成熟,强化脑区之间的链接、以及功能性脑回路的形成上。此外,作者还乐观估计,未来几年,关于脑类器官与其他身体区域的类器官之间复杂相互作用的研究或将备受瞩目,以期解码器官在健康和疾病状态下的相互影响。
近岸蛋白具备多种经类器官培养验证的细胞因子,让您的类器官培养更可控!
参考资料
1. Lancaster, Madeline A et al. “Cerebral organoids model human brain development and microcephaly.”Naturevol. 501,7467 (2013): 373-9. doi:10.1038/nature12517
2. Birtele, Marcella et al. “Modelling human brain development and disease with organoids.” Nature reviews. Molecular cell biology, 10.1038/s41580-024-00804-1. 12 Dec. 2024, doi:10.1038/s41580-024-00804-1
3. Shaker, Mohammed R et al. “Rapid and Efficient Generation of Myelinating Human Oligodendrocytes in Organoids.” Frontiers in cellular neuroscience vol. 15 631548. 17 Mar. 2021, doi:10.3389/fncel.2021.631548
4. Dao, Lan et al. “Modeling blood-brain barrier formation and cerebral cavernous malformations in human PSC-derived organoids.” Cell stem cell vol. 31,6 (2024): 818-833.e11. doi:10.1016/j.stem.2024.04.019
5.Rifes, Pedro et al. “Modeling neural tube development by differentiation of human embryonic stem cells in a microfluidic WNT gradient.” Nature biotechnology vol. 38,11 (2020): 1265-1273. doi:10.1038/s41587-020-0525-0
6.Qian, Xuyu et al. “Sliced Human Cortical Organoids for Modeling Distinct Cortical Layer Formation.” Cell stem cell vol. 26,5 (2020): 766-781.e9. doi:10.1016/j.stem.2020.02.002
7.陈倩文, 赵思琪, 彭耀进. 类器官:技术创新与伦理争议[J]. 合成生物学, 2024, 5(4): 898-907
